抗体(Antibody)这个词首次出现在保罗·埃尔利希1891年10月公布的《免疫力的试验性研究》这篇文章中,德语的抗体“Antikörper”出现在该文章的结论部分。其中指出了“如果两种物质导致两种不同抗体的产生,那么这两种物质必然是不同的”。然而这一术语并没有立即被接受,还有被建议使用的其它几个术语,如:免疫体(Immunkörper)、介体受体(Amboceptor)、介体(Zwischenkörper)、物质敏感体(substance sensibilisatrice)、连接体(copula)、德氏体(Desmon)、白细胞素(philocytase)、介体固定体(fixateur)以及免疫素(Immunisin)等。抗体和抗毒素(Antitoxin)字面结构相似,概念则和免疫体(Immunkörper)类似。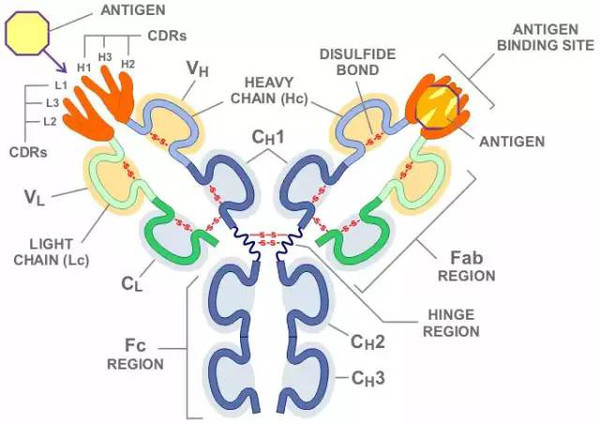
根据E. Padlan公布的抗体结构图,朱利·安沃斯-安德烈*为斯克里普斯研究所佛罗里达分部创作了雕塑《西方天使》(2008年) 塑像仿照列奥纳多·达·芬奇的维特鲁威人,将抗体放置到一个圆环的中间,寓意其对于人类的重要意义。
针对抗体的研究始于1890年,埃米尔·阿道夫·冯·贝林及北里柴三郎首次描述了抗体对白喉及破伤风痉挛毒素的抵抗作用。他们两人将体液免疫理论往前推进了一步,提出了血清中存在一种可以与外来抗原相反应的某种介质的假设。保罗·埃尔利希受到了他们的这一想法的启发,于1897年提出了抗体与抗原互动的侧链理论假说。他假设道,在细胞的表面存在能和特定毒素发生一把钥匙对应一把锁类似的特异结合作用的感受器,而结合反应则会进一步导致相关抗体的生产。其他研究人员在之后的研究中认为,抗体可以在血液中稳定独立存在。在1904年,奥姆罗斯·莱特进一步提出通过可溶性抗体在细菌的表面包裹标识,使其成为吞噬作用的目标,并最终被消灭。这一过程被他命名为调理作用。
到了二十世纪二十年代,迈克尔·海德堡和奥斯瓦尔德·埃弗里观察到抗原可以被抗体所凝结,并进一步发现抗体是一种蛋白质。在三十年代,约翰·马拉克对抗原-抗体结合活动的生物化学性质做了更详尽的实验。接下来的一次重大突破发生在四十年代,莱纳斯·鲍林通过抗体抗原的互动能力取决于各自的形状而不是其化学成分,证明了埃尔利希所提出的一把钥匙配一把锁的免疫学理论。1948年,阿斯特丽德·法戈瑞奥司发现B细胞的其中一种形式浆细胞就是负责生产抗体的工厂。
此后,研究工作的重点转向了识别抗体蛋白质结构中各部分的作用。二十世纪六十年代,杰拉尔德·埃德尔曼和约瑟夫·盖里发现了抗体的轻链,并且发现这和1845年由亨利·本册·琼斯所发现的本周氏蛋白质是同一种物质,这是一项重大的突破。紧接着,埃德尔曼在进一步发现抗体中的重链和轻链是由双硫键连接在一起的。与此同时,罗德尼·罗伯特·波特识别出了免疫球蛋白的抗体结合区(Fab)及抗体尾部的可结晶区。根据这些发现,科学家们对免疫球蛋白的结构进行了推测,并描述了IgG蛋白质的完整氨基酸序列。
以上这些发现,使得他们被共同授予1972年的诺贝尔生理学或医学奖。Fv区则由戴维·吉沃尔(David Givol)所首先制备和识别。正当人们对抗体的大多数早期研究还集中在IgM和IgG上时,六十年代还发生了重要的事情:托马斯·托马西发现了属于新种型的分泌形态IgA抗体,戴维·S·罗维和约翰·L·费伊则识别出了IgD,石坂公成和石坂照子夫妇则共同发现了与过敏反应有关的抗体种型IgE。1976年,利根川进对免疫球蛋白相关基因进行研究,发现了抗体通过基因重排实现多样性的体细胞超突变基本原理。
抗体的结构特征

抗体,又称为免疫球蛋白(immunoglobulin,简称Ig),是一种主要由浆细胞分泌,被免疫系统用来鉴别与中和外来物质如细菌、病毒等病原体的大型Y形蛋白质,仅被发现存在于脊椎动物的血液等体液中,及其B细胞的细胞膜表面。抗体能通过其可变区唯一识别特定外来物的一个独特特征,该外来目标被称为抗原(Antigen)。蛋白上Y形的其中两个分叉顶端都有一被称为互补位(抗原结合位)的锁状结构,该结构仅针对一种特定的抗原表位。这就像一把钥匙只能开一把锁一般,使得一种抗体仅能和其中一种抗原相结合。 抗体和抗原的结合完全依靠非共价键的相互作用,这些非共价键的相互作用包括氢键、范德华力、电荷作用和疏水作用。这些相互作用可以发生在侧链或者多肽主干之间。正因这种特异性的结合机制,抗体可以“标记”外来微生物以及受感染的细胞,以诱导其他免疫机制对其进行攻击,又或直接中和其目标,例如通过与入侵和生存至关重要的部分相结合而阻断微生物的感染能力等。针对不同的抗原,抗体的结合可能阻断致病的生化过程,或者召唤巨噬细胞消灭外来物质。而抗体能够与免疫系统的其它部分交互的能力,是通过其Fc区底部所保留的一个糖基化座实现的。体液免疫系统的主要功能便是制造抗体。抗体也可以与血清中的补体一起直接破坏外来目标。
抗体是一种高分子球状血液蛋白质,重量约为150kDa。由于在部分氨基酸残基中含有糖链,抗体也是一种糖蛋白。能发挥功能的基本单位是一个免疫球蛋白单体。在分泌形态的抗体中包括:二聚体IgA、真骨附类鱼的四聚体IgM以及哺乳动物的五聚体IgM。
多种免疫球蛋白结构域构成了抗体的两条重链(红色和蓝色部分),以及两条轻链(绿色和黄色)。这些结构域包含7次(恒定区)及9次(变化区)的β折叠。可发生变化的部分称为V区(或变化区、可变区),而不变的部分称为C区(或恒定区)。
免疫球蛋白结构域
抗体的单体是一个Y形的分子,有4条多肽链组成。其中包括两条相同的重链,以及两条相同的轻链,之间由双硫键连接在一起。每一条链均由称为免疫球蛋白结构域的多个结构域所组成。每一个结构域大约包含70至110个氨基酸,并根据大小和功能分门别类。例如可变域IgV以及恒定域IgC。它们的折叠方式很特别:通过两次β折叠将另一条链卷入其中形成三明治状,互相之间通过半胱氨酸和其它带电荷氨基酸紧密结合。
重链
哺乳动物的免疫球蛋白重链有5种,分别用希腊字母记为:α、δ、ε、γ以及μ。根据重链类型的不同,抗体被分为不同的种型,它们被发现依序分别存在于抗体IgA、IgD、IgE、IgG以及IgM中。不同的重链其大小和组成各不相同:α和γ大约有450个氨基酸组成,而μ和ε大约有550个氨基酸组成。
1. 抗原结合区(Fab)
2. 抗原结晶区(Fc)
3. 蓝色的重链有一个可变区(VH),紧随其后的一个恒定区(CH1),一个枢纽区,以及另两个恒定区(CH2 and CH3)组成
4. 绿色的轻链包含一个可变区(VL)以及一个恒定区(CL)
5. 抗原结合点
6. 枢纽区.
在鸟类的血液和蛋清中,还发现了被称为IgY的血清抗体种型。这种抗体种型和哺乳动物的IgG有很大的区别。然而在一些旧资料,甚至是生命科学商业产品的网站上,仍然称之为IgG。这是错误的,并且容易引起混淆。
每一条重链有两个区域:恒定区与可变区。同种型的抗体,其恒定区都是一样的,但不同种型之间该区域是不相同的。例如:γ、α以及δ型重链由三个免疫球蛋白结构域串联而成,并且还有一个用于增加弹性的铰链区;而μ及ε型重链则包括四个免疫球蛋白结构域。不同B细胞所生产抗体的重链可变区是不同的,但是同一个B细胞及其克隆体所生产的不同种型抗体的可变区则是完全相同的。重链的可变区由一个结构域组成,包含大110个氨基酸。
轻链
免疫球蛋白轻链由大约211至217个氨基酸组成,分为两个结构域,分别是恒定区和可变区。哺乳动物的轻链有两种,分别命名为λ(lambda)和κ(kappa)。每一个抗体的两个轻链的恒定区永远是完全相同的,例如对于哺乳动物而言,同一个抗体要么是λ型,要么是κ,不会同时存在。在如软骨鱼纲(鲨鱼)及真骨下纲的低级脊椎动物中,还可发现其它类型的轻链,如ι(iota)型。
CDRs、Fv、Fab以及Fc结构域
抗体的某些部分具有独特的功能。比如说Y形的臂区,包含了两个可以结合抗原的位点,是识别外来物的关键所在。该区域被称为Fab区,即抗原结合区段(fragment, antigen binding)。无论是重链还是轻链,抗原结合区段均包括一个可变区与一个恒定区,其中可变区的互补位成型于抗体单体氨基酸链的末端。可变区又被称为Fv区,是与抗体结合的最关键区域,无论是轻链还是重链都包含该区域。实际上可变区的变化并非随机或者均匀散布的。更具体的说,这些变化分布在三个可变的β折叠-转角上,该区域被称为互补决定区(Complementarity Determining Region,CDR),也叫做高变区。在免疫网络理论中,每个抗体的互补决定区又被称为独特型或者基因型。适应性免疫系统的适应过程,就是依靠有各个独特型之间的互动来进行调整的。
Y形结构的基座的作用是调节免疫细胞的活动,该区域被称为Fc区(Fragment crystallizable region,可结晶区域片段),由两条重链组成。根据抗体类型不同,该区域的每一条重链由2个或者3个恒定结构域组成。因此,Fc区可通过与特定类型的Fc感受器,或者其它免疫分子如补体蛋白质相结合,来确保每个抗体可对一特定抗原产生一个正确的免疫应答。通过这一过程,可引发不同的生理学效果,包括识别调理颗粒、细胞溶解,以及肥大细胞、嗜碱性粒细胞和嗜酸性粒细胞的脱颗粒过程。
转自网络,如有侵权请告之,立即删除。